rng电子竞技俱乐部中心官网_rng最新战队成员名单欢迎您! 客服热线:0523-84865312
2018年8月31日,国家药品监督管理局官网发布的《医疗器械质量差事情监控监测和再点评管理方法》(国家商场监督管理总局令第1号)(下文简称《方法》)给医疗器械注册人提出了一系列新的作业要求,其中就包含对上市后的医疗器械编撰定时危险点评陈述。根据《方法》第二章第十四条持有人的首要责任的内容,持有人应做到树立体系、装备人员和组织、陈述不良事情、操控危险、发布信息、编撰定时危险点评陈述、再点评、合作查询。本文就对在编撰该陈述过程中的关键进行了收拾,供我们参阅。
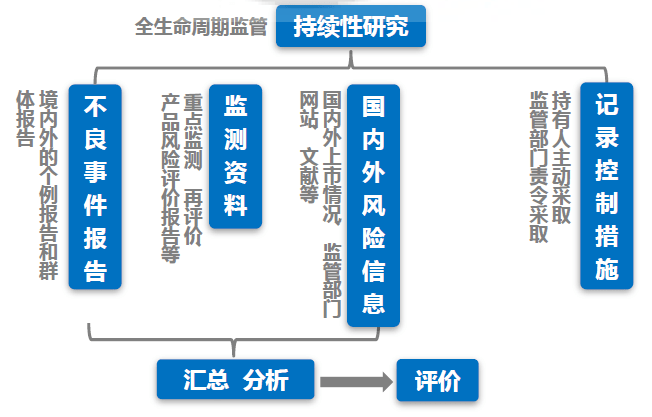
留意:(1)即便没发生不良事情,仍需求定时准时提交定时危险点评陈述;(2)不良事情陈述是定时危险点评陈述中的一部分,但不是全部内容;(3)监测材料是国内外危险信息的汇总和剖析。
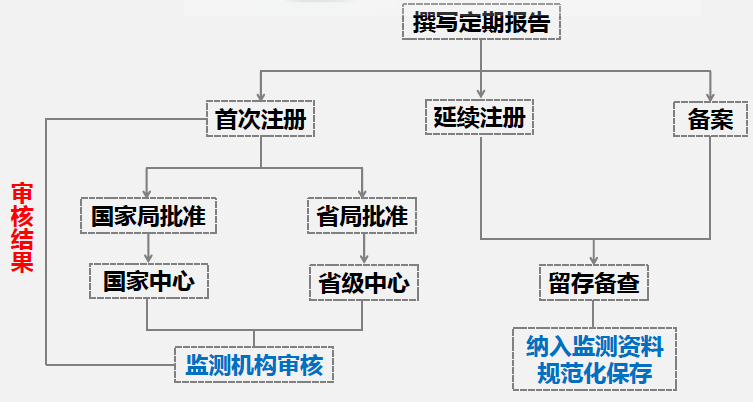
留意:(1)关于初次注册的第二、三类产品,网上提交材料后,根据批阅组织的不同,会由国家药监局或省级药监局进行审阅,审阅成果可在网上查询;(2)关于连续注册和存案产品,不要求在线提交定时危险点评陈述,编撰完成后留存备检即可,但一起需把其归入监测材料规范化进行保存。
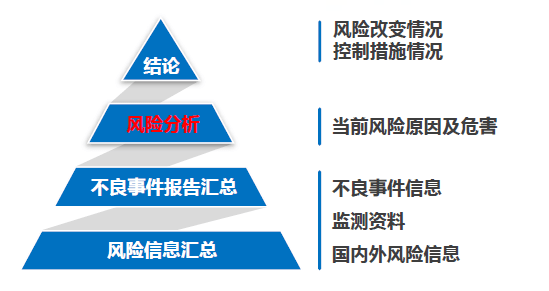
经过对医疗器械产品的不良事情进行监测,定时剖析产品的危险是确保产品安全的重要方法之一。因而,在编撰定时危险点评陈述时,注册人应从辨认危险和缘由剖析两方面编撰危险剖析,点评其对安全性的影响。辨认危险包含以下内容。
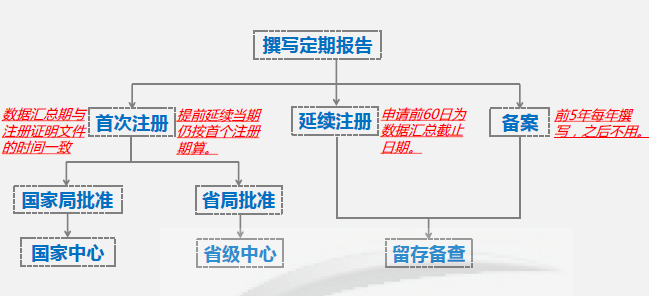
(1)数据汇总期与注册证明文件的时刻共同:如某个产品的获证日期是2018年8月10日,那么在2019年度要提交的定时危险点评陈述的数据汇总期便是2018年8月10日至2019年8月9日。
(2)提早连续注册的产品的当期陈述的数据汇总期仍按首个注册期核算:如某个产品的注册证于2020年8月30日到期,但它在2020年5月就获得了连续注册证,关于该产品,当期陈述仍以2020年8月30日作为汇总期的完毕日期。

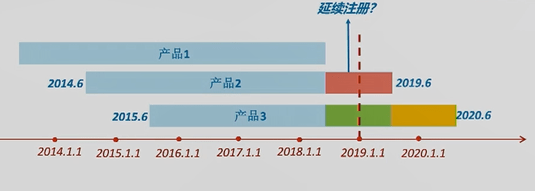
(1)上图中3个II类产品提交定时危险点评陈述时,数据汇总期应该分别是哪一段时刻呢?
产品1的首个注册期是2013年某月某日到2018年某月某日。对这样的产品来说,2019年1月1日《方法》收效时,其处于连续注册状况,所以只需预备下一整个连续周期的定时危险点评陈述即可。
产品2的首个注册期是2014年6月至2019年6月。注册人应提交2019年的年度陈述,数据汇总期是2018年6月至2019年6月,即上图中赤色时刻段。
产品3的首个注册期是2015年6月至2020年6月。该产品要提交两期定时危险点评陈述。分别是上图中绿色时刻段和黄色时刻段。
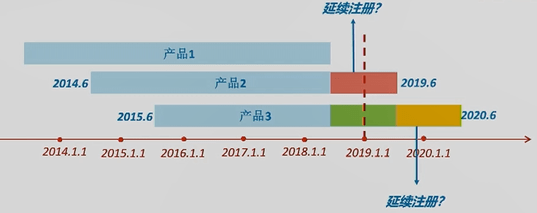
(2)若上图中产品2在蓝色箭头时刻点进行了连续注册,定时危险点评陈述应怎么提交?
答:在《方法》收效时,该产品现已处于连续注册状况。所以该产品不必提交2019年的年度定时危险点评陈述。
(3)若上图中产品3在蓝色箭头时刻点进行了连续注册,其当期定时危险点评陈述应怎么提交?
答:《方法》规则,提早连续注册,仍应依照首个注册期要求,提交当期定时危险点评陈述。产品3的当期即为黄色时刻段,所以即便其在黄色时刻段内连续注册,提交的定时危险点评陈述也有必要是整个黄色时刻段内的陈述。
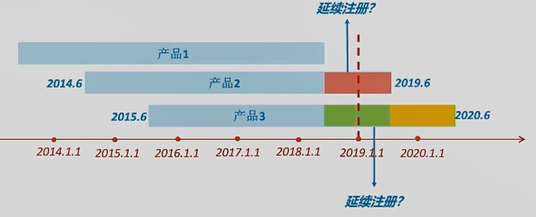
(4)若上图中产品3在绿色时刻段内就进行了连续注册,其当期定时危险点评陈述应怎么提交?
答:产品3的本期定时危险点评陈述的数据汇总期便是整个绿色时刻段。黄色时刻段的数据可作为下一次连续注册时定时危险点评陈述中的一部分内容。
1. 产品处于首个注册期内,有出售活动后中止出产出售的,是否仍需求继续提交定时危险点评陈述?
需求。即便已中止出产出售,商场上仍可能会有该产品在流转运用;为了可以更好的确保该产品的危险可控,仍需求定时准时提交定时危险点评陈述。
需求。在体系内提交定时危险点评陈述时,可在陈述正文部分做扼要阐明,或由公司提交“该产品从未在国内外上市”的阐明,来代替陈述的正文。
尚不需求。但应急注册产品转为正式注册产品后,需依照首个注册期的要求,提交定时危险点评陈述。一起,第一份点评陈述的数据汇总期应包括其应急注册期。
rng电子竞技俱乐部官网 位于制造业基地的长三角产业带中心——美丽的滨江之城——靖江,交运顺捷,政通人和。组建成立于一九九七年,注册资本:人民币5009万元,主要从事医药、卫生、电子、环保、轻工、